Laporan Praktikum Kimia - Percobaan Kepolaran Senyawa
Sabtu, 19 Agustus 2017
 Di sekolah saya, materi kimia sudah menginjak pada bab ikatan kimia. Pada subbab "kepolaran", guru mengajak murid-muridnya untuk melakukan praktikum kimia mengenai percobaan kepolaran senyawa, di mana tujuan dalam praktikum tersebut adalah untuk mengetahui kepolaran beberapa molekul dan hubungannya dengan keelektronegatifan. Setelah melakukan praktikum, siswa disuruh untuk membuat laporan praktikum. Inilah laporan praktikum kimia saya. Laporan ini saya terbitkan di blog agar bisa dimanfaatkan oleh para pelajar Indonesia yang sedang membutuhkan.
Di sekolah saya, materi kimia sudah menginjak pada bab ikatan kimia. Pada subbab "kepolaran", guru mengajak murid-muridnya untuk melakukan praktikum kimia mengenai percobaan kepolaran senyawa, di mana tujuan dalam praktikum tersebut adalah untuk mengetahui kepolaran beberapa molekul dan hubungannya dengan keelektronegatifan. Setelah melakukan praktikum, siswa disuruh untuk membuat laporan praktikum. Inilah laporan praktikum kimia saya. Laporan ini saya terbitkan di blog agar bisa dimanfaatkan oleh para pelajar Indonesia yang sedang membutuhkan.
LAPORAN PRAKTIKUM KIMIA
PERCOBAAN KEPOLARAN SENYAWA
Disusun Oleh:
Muhammad Thomas Wildan
21/X G IPA
Guru Mata Pelajaran:
Siti Ismuzaroh, S.Pd., M.Pd.
SMA NEGERI 1 BATANG
TAHUN AJARAN 2015/2016
SMA NEGERI 1 BATANG
TAHUN AJARAN 2015/2016
A. JUDUL: Percobaan Kepolaran Senyawa
B. TUJUAN:
a. Mengetahui kepolaran beberapa molekul dan hubungannya dengan keelektronegatifan.
b. Memenuhi tugas kimia.
C. LANDASAN TEORI:
Perbedaan keelektronegatifan dua atom menimbulkan kepolaran molekul. Adanya perbedaan keelektronegatifan tersebut menyebabkan pasangan elektron ikatan lebih tertarik ke salah satu unsur sehingga membentuk dipol. Adanya dipol inilah menyebabkan molekul polar.
Pada senyawa HCl, pasangan elektron milik bersama akan lebih dekat pada Cl karena daya tarik terhadap elektronnya lebih besar dibandingkan H. Hal itu menyebabkan terjadinya polarisasi/ pengkutuban muatan/dipol pada ikatan H – Cl. Atom Cl lebih negatif daripada atom H (keelektronegatifan Cl = 3,0 dan H = 2,1). Jika dalam suatu ikatan kovalen terjadi pengkutuban muatan, maka ikatan tersebut dinamakan ikatan kovalen polar. Molekul yang dibentuknya dinamakan molekul polar.
Contoh:
1. Molekul kovalen polar: HCl, HBr, HI, HF, H2O, NH3.
2. Molekul kovalen non polar: H2, O2, Cl2, N2, CH4, BF3.
Pada ikatan-ikatan kovalen yang terdiri lebih dari dua unsur/poliatomik, kepolaran molekulnya ditentukan oleh hal-hal berikut:
Pada senyawa HCl, pasangan elektron milik bersama akan lebih dekat pada Cl karena daya tarik terhadap elektronnya lebih besar dibandingkan H. Hal itu menyebabkan terjadinya polarisasi/ pengkutuban muatan/dipol pada ikatan H – Cl. Atom Cl lebih negatif daripada atom H (keelektronegatifan Cl = 3,0 dan H = 2,1). Jika dalam suatu ikatan kovalen terjadi pengkutuban muatan, maka ikatan tersebut dinamakan ikatan kovalen polar. Molekul yang dibentuknya dinamakan molekul polar.
Contoh:
1. Molekul kovalen polar: HCl, HBr, HI, HF, H2O, NH3.
2. Molekul kovalen non polar: H2, O2, Cl2, N2, CH4, BF3.
Pada ikatan-ikatan kovalen yang terdiri lebih dari dua unsur/poliatomik, kepolaran molekulnya ditentukan oleh hal-hal berikut:
Jumlah momen dipol; jika jumlah momen dipol = 0, molekulnya bersifat nonpolar. Jika momen dipol ≠ 0, maka molekulnya bersifat polar.
Resultan vektor; jika resultan vektor = 0, molekulnya bersifat nonpolar. Jika resultan vektor ≠ 0, maka molekulnya bersifat polar.
Pasangan elektron bebas; molekul nonpolar umumnya tidak memiliki pasangan elektron bebas, sementara itu molekul polar umumnya memiliki pasangan elektron bebas.
D. ALAT DAN BAHAN:
1. Buret dan statif
2. Gelas kimia
3. Corong
4. Penggaris mika
5. Kain wol/rambut
6. Aquades
7. Etanol
8. Larutan garam dapur
9. Cuka
10. Larutan gula
E. LANGKAH KERJA:
1. Memasang buret pada statifnya sembari menyiapkan gelas kimia, corong, dan penggaris.
2. Mengisi buret dengan aquades terlebih dahulu.
3. Menggosok penggaris mika ke rambut (10-30 gosokan).
4. Mengalirkan aquades yang akan diteliti kepolarannya ke dalam buret dengan cara memutar keran buret dan mendekatkan penggaris pada aliran tersebut.
5. Mengamati aliran aquades.
6. Mengulangi langkah kerja di atas secara bergantian untuk menguji zat cair yang lainnya (etanol, larutan garam dapur, cuka, dan larutan gula).
2. Gelas kimia
3. Corong
4. Penggaris mika
5. Kain wol/rambut
6. Aquades
7. Etanol
8. Larutan garam dapur
9. Cuka
10. Larutan gula
E. LANGKAH KERJA:
1. Memasang buret pada statifnya sembari menyiapkan gelas kimia, corong, dan penggaris.
2. Mengisi buret dengan aquades terlebih dahulu.
3. Menggosok penggaris mika ke rambut (10-30 gosokan).
Penggosokan dihentikan ketika penggaris agak panas. Kemudian menggunting beberapa kertas hingga bentuk potongan-potongan kecil, lalu mendekatkan penggaris pada potongan kertas itu. Bila potongan kertas itu tertarik, maka penggaris sudah bermuatan listrik.
4. Mengalirkan aquades yang akan diteliti kepolarannya ke dalam buret dengan cara memutar keran buret dan mendekatkan penggaris pada aliran tersebut.
5. Mengamati aliran aquades.
Apabila zat cair tersebut dapat dibelokan oleh penggaris yang telah bermuatan, maka zat cair tersebut adalah polar, begitu pula sebaliknya.
6. Mengulangi langkah kerja di atas secara bergantian untuk menguji zat cair yang lainnya (etanol, larutan garam dapur, cuka, dan larutan gula).
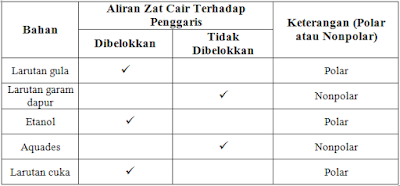
F. DATA PENGAMATAN:
G. ANALISA DATA:
Senyawa polar: Senyawa yang terbentuk akibat adanya suatu ikatan antarelektron pada unsur-unsurnya. Hal ini terjadi karena unsur yang berikatan tersebut mempunyai nilai keelektronegatifitas yang berbeda sehingga senyawa polar dapat menghantarkan arus listrik.
Senyawa non polar: Senyawa yang terbentuk akibat adanya suatu ikatan antarelektron pada unsur-unsur yang membentuknya. Hal ini terjadi karena unsur yang berikatan mempunyai nilai elektronegatifitas yang sama/hampir sama. Senyawa nonpolar tidak dapat menghantarkan arus listrik.
Aquades: Berdasarkan susunan ruang atomnya, molekul H2O berbentuk tidak simetris. Elektron tidak tersebar merata. Dalam molekul H2O pusat muatan (pol) negatif terletak pada atom O, sedangkan pol positif terletak di antara atom H, sehingga air bersifat polar karena jika digambarkan ikatan polar sebagai vektor maka molekul H2O resultan vektornya tidak sama dengan nol. Dalam percobaan ini pun dapat diketahui bahwa aliran air (H2O) tertarik oleh penggaris yang bermuatan listrik, ini menandakan bahwa air memiliki sifat polar.
Etanol: Pada saat keran buret dibuka, etanol yang mengalir menuju gelas kimia yang awalnya lurus sewaktu didekati oleh penggaris beraliran listrik mengalami pembelokkan. Hal ini karena molekul etanol mempunyai ikatan kovalen polar.
Larutan Gula: Larutan gula dengan rumus kimia C6H12O6 merupakan campuran dari glukosa yang dilarutkan dalam pelarut air. Ketika keran buret dibuka dan penggaris didekatkan, aliran glukosa yang awalnya lurus ternyata dibelokkan. Hal ini menunjukkan bahwa larutan gula mempunyai sifat polar.
Larutan Garam Dapur: Larutan garam dapur dengan rumus kimia NaCl merupakan campuran dari unsur Natrium dan unsur Klorida. Ketika keran buret dibuka dan penggaris didekatkan, aliran larutan garam dapur yang awalnya lurus ternyata tidak dibelokkan. Hal ini menunjukkan bahwa larutan gula mempunyai sifat nonpolar.
Larutan Cuka: Pada saat keran buret dibuka, HCl yang mengalir menuju gelas kimia yang awalnya lurus, sewaktu didekati oleh penggaris beraliran listrik mengalami pembelokan. Hal ini dikarenakan molekul HCl mempunyai ikatan kovalen polar.
Senyawa non polar: Senyawa yang terbentuk akibat adanya suatu ikatan antarelektron pada unsur-unsur yang membentuknya. Hal ini terjadi karena unsur yang berikatan mempunyai nilai elektronegatifitas yang sama/hampir sama. Senyawa nonpolar tidak dapat menghantarkan arus listrik.
Aquades: Berdasarkan susunan ruang atomnya, molekul H2O berbentuk tidak simetris. Elektron tidak tersebar merata. Dalam molekul H2O pusat muatan (pol) negatif terletak pada atom O, sedangkan pol positif terletak di antara atom H, sehingga air bersifat polar karena jika digambarkan ikatan polar sebagai vektor maka molekul H2O resultan vektornya tidak sama dengan nol. Dalam percobaan ini pun dapat diketahui bahwa aliran air (H2O) tertarik oleh penggaris yang bermuatan listrik, ini menandakan bahwa air memiliki sifat polar.
Etanol: Pada saat keran buret dibuka, etanol yang mengalir menuju gelas kimia yang awalnya lurus sewaktu didekati oleh penggaris beraliran listrik mengalami pembelokkan. Hal ini karena molekul etanol mempunyai ikatan kovalen polar.
Larutan Gula: Larutan gula dengan rumus kimia C6H12O6 merupakan campuran dari glukosa yang dilarutkan dalam pelarut air. Ketika keran buret dibuka dan penggaris didekatkan, aliran glukosa yang awalnya lurus ternyata dibelokkan. Hal ini menunjukkan bahwa larutan gula mempunyai sifat polar.
Larutan Garam Dapur: Larutan garam dapur dengan rumus kimia NaCl merupakan campuran dari unsur Natrium dan unsur Klorida. Ketika keran buret dibuka dan penggaris didekatkan, aliran larutan garam dapur yang awalnya lurus ternyata tidak dibelokkan. Hal ini menunjukkan bahwa larutan gula mempunyai sifat nonpolar.
Larutan Cuka: Pada saat keran buret dibuka, HCl yang mengalir menuju gelas kimia yang awalnya lurus, sewaktu didekati oleh penggaris beraliran listrik mengalami pembelokan. Hal ini dikarenakan molekul HCl mempunyai ikatan kovalen polar.
H. KESIMPULAN:
Berdasarkan hasil pengamatan, dapat disimpulkan bahwa apabila suatu benda bermuatan listrik didekatkan pada cairan tertentu maka akan ada reaksi yang berbeda-beda tergantung molekul cairan tersebut. Reaksi pembelokan suatu cairan ketika didekati benda bermuatan listrik terjadi apabila cairan tersebut mempunyai ikatan kovalen polar. Sedangkan apabila tidak ada reaksi, maka cairan tersebut mempunyai ikatan kovalen nonpolar.
I. SARAN:
Sebaiknya bersungguh-sungguh dan lebih sabar dalam melaksanakan praktikum guna memperoleh hasil praktikum yang benar dan maksimal. Pada saat menempelkan penggaris ke zat cair, diperlukan ketelitian dalam mengamati kondisi zat cair, apakah zat cair dibelokkan atau tidak.
J. REFERENSI:
Terima Kasih Atas Kunjungan Anda
Judul : Laporan Praktikum Kimia - Percobaan Kepolaran Senyawa
Diterbitkan Oleh : Muhammad Thomas Wildan
Jika ingin mengutip artikel ini, dimohon untuk mencantumkan link yang menuju ke artikel Laporan Praktikum Kimia - Percobaan Kepolaran Senyawa. Terima kasih.
Judul : Laporan Praktikum Kimia - Percobaan Kepolaran Senyawa
Diterbitkan Oleh : Muhammad Thomas Wildan
Jika ingin mengutip artikel ini, dimohon untuk mencantumkan link yang menuju ke artikel Laporan Praktikum Kimia - Percobaan Kepolaran Senyawa. Terima kasih.
Label:
Kimia